SinChro™シンクロ
TL Genomicsでは、PCRベースの新しい染色体検査技術を開発することに成功しました。SinChro™(シンクロ)と名付けたこの技術は、染色体の検査現場で日常的に使われているFISH法(Fluorescent In Situ Hybridization)に比べて、簡便でスループット性に優れ、高感度というアドバンテージがあります。
SinChro™:簡便でスループット性に優れたPCRベースの染色体検査技術
染色体の検査で日常的に用いられるFISH法は、試料をスライドグラスに固定する作業からスタートします。その後、オーバーナイトで試料と蛍光プローブとハイブリダイズさせ、Wash液に何度もつけて洗浄し、蛍光顕微鏡でシグナルを観察します。自動化されているステップはあるものの、検査全体では非常に手間がかかるため、検査現場ではより簡便でスループット性に優れた技術が求められてきました。
SinChro™法は、上記の課題を解決する画期的な技術です。定量PCR法のような分子生物学的手法で、一つ一つの細胞が持つ染色体の本数を1本や2本とカウントすることは非常に困難ですが、SinChro™法はその課題を克服し、染色体を1本単位で正確に計測できます。例えば、骨髄異形成症候群という病気では、5番染色体や7番染色体の欠損は予後不良の因子として知られていますが、SinChro™法は、そのような染色体の数的異常を正確に検出することができます。

微少空間における複数分子の鋳型DNAを正確に計測する
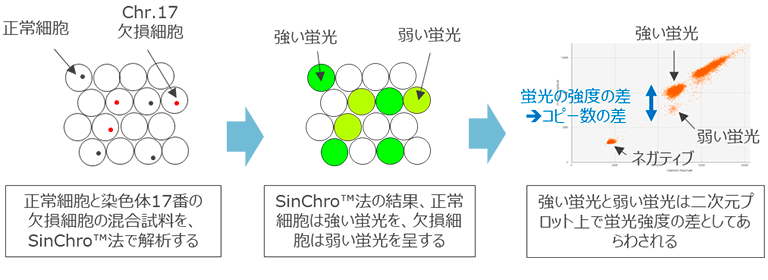
SinChro™法では、微小区画の中でPCR反応を行います。これは、一般的な条件のPCRに比べて10,000倍以上小さな空間です。このため、反応効率が格段に良く、1分子のDNAでも確実に増幅させることができます。しかしながら、反応効率が良い反面、鋳型となるDNAの数に関する情報はPCR反応終了時点では失われてしまいます。
SinChro™法は、この微小区画に複数個のDNAが存在する場合に、その数を微小空間ごとに正確に計測できる技術で、TL Genomics独自の発明※1で鋳型DNAの数を蛍光強度の差に変換して計測しています。
※1特許申請済:特願2020-216149
SinChro™:新たな検査技術としての可能性
TL Genomicsでは、SinChro™の開発パイプラインの一つとして、骨髄異形成症候群(myelodysplastic syndromes:MDS)の染色体異常を検出する新たな体外診断用医薬品の開発に取り組んでいます。骨髄異形成症候群という病気では、いくつかの染色体の数的異常が観察され、その検査結果は治療方針を決めるうえで重要な情報となります。
また、SinChro™を使って血液細胞中の性染色体の後天的な喪失を調べることで、エイジングレベルを推定できる新たなヘルスケアサービスを提供しています。